- PRODUCTS產品介紹
- Cell Culture Cell Culture
- Animal Cell Culture Animal Cell Culture
- Insect Cell Culture Insect Cell Culture
- Stem Cell Culture Stem Cell Culture
- Immune Cell Culture Immune Cell Culture
- Antibiotic/Cytokine/Growth Factor Antibiotic/Cytokine/Growth Factor
- Cell Preparation Cell Preparation
- Cell Storage/Transportion Cell Storage/Transportion
- Cell Culture Supplements Cell Culture Supplements
- Cell Dissociation & Buffer Solutions Cell Dissociation & Buffer Solutions
- Extracellular Matrix Extracellular Matrix
- Cell Isolation Cell Isolation
- Human Platelet Lysate Human Platelet Lysate
- Animal Cell Culture
- Cell Therapy Cell Therapy
- MSC
- NK
- CIK
- T Cell
- DC
- iPS
- Stem Cell-CD34 Stem Cell-CD34
- Adipose Stem Cell Adipose Stem Cell
- Water-Free Thawing System Water-Free Thawing System
- Blood biopsy preparation Blood biopsy preparation
- Quality Control Quality Control
- GMP Grade Cytokine GMP Grade Cytokine
- Common Chemicals & Buffers & Lab Tools Common Chemicals & Buffers & Lab Tools
- Life Science Life Science
- Exosome Research Exosome Research
- Spectradyne-Microfluidic Nanoparticle Analysis
- Corning-VideoDrop
- Immunostep- Lyophilized Exosome Standards
- Immunostep-ExoStep Platform
- Immunostep-Exosome Isolation Columns (SEC)
- GeneCopoeia Lentifect™ Exosome Labeling Lentiviral
- GeneCopoeia miProfile™ Exosome miRNA qPCR arrays
- Exosome Memebrane / Protein Dye
- DNA/RNA Research
- miRNA/shRNA/siRNA Research
- Protein Research
- In Vivo Assay In Vivo Assay
- Cloning & Clone Collection
- Transfection & Transduction
- IHC
- Cell-Based Assay
- Mitochondria Research Mitochondria Research
- Antibody/Antigen
- ELISA ELISA
- Antibody Labeling Antibody Labeling
- mRNA/Oligos/Nucleotide
- Microbial Research Microbial Research
- Ultra high content imaging
- Tumor Research Tumor Research
- Microarray Microarray
- Exosome Research
- Pharma Manufacturing & QC Pharma Manufacturing & QC
- Impurity Detection
- Micoplasma Detection Micoplasma Detection
- Endotoxin Remove Endotoxin Remove
- Visual Inspection Visual Inspection
- Mycobacteria Detection Mycobacteria Detection
- Nanoparticle Analyzer Nanoparticle Analyzer
- Cell Culture
- NEWS最新消息
- PROMOTIONS促銷活動
- SUPPLIER代理品牌
- AAjinomoto-iPSAbcamAbebioAbbexaAbcoreAlpha-TecAkadeum
- BBiCell ScientificBIO-HELIXBiolineBioLife SolutionsBio X Cell
- CCorningCYGNUSCompass BiomedicalCUSABIOCytori Therapeutics IncCANDOR BioscienceCreative BioMart
- DDojindo
- EExpression SystemsEastCoast BioElixirgen Scientific
- FFast Forward DiscoveriesFortius BioFisher Scientific
- GGoldBioGenlantisGeneCopoeia
- HHyTest Ltd
- IImmunostepiRealIrvine ScientificInVitriaImmuno-Biological Laboratories
- KKohjin BioKingfisher Biotech
- LLIPOSOMA ─ Clodronate Liposomes
- MMatrixome & NippiMedicagoMeridian Life Science
- NNonacus
- QQIAGEN
- PProtein ArkProFoldin-ProteomicsProSpec
- SSHIMADZUSignaGenScyTek Laboratories IncSMOBIOSpectradyne
- TTriLink BiotechnologiesTymora Analytical
- WWorthingtonWaken X BioLife Solutions
- ABOUT關於我們
- CONTACT聯絡我們
- 產品介紹
- Cell Culture Cell Culture
- Animal Cell Culture Animal Cell Culture
- Insect Cell Culture Insect Cell Culture
- Stem Cell Culture Stem Cell Culture
- Immune Cell Culture Immune Cell Culture
- Antibiotic/Cytokine/Growth Factor Antibiotic/Cytokine/Growth Factor
- Cell Preparation Cell Preparation
- Cell Storage/Transportion Cell Storage/Transportion
- Cell Culture Supplements Cell Culture Supplements
- Cell Dissociation & Buffer Solutions Cell Dissociation & Buffer Solutions
- Extracellular Matrix Extracellular Matrix
- Cell Isolation Cell Isolation
- Human Platelet Lysate Human Platelet Lysate
- Animal Cell Culture
- Cell Therapy Cell Therapy
- MSC
- NK
- CIK
- T Cell
- DC
- iPS
- Stem Cell-CD34 Stem Cell-CD34
- Adipose Stem Cell Adipose Stem Cell
- Water-Free Thawing System Water-Free Thawing System
- Blood biopsy preparation Blood biopsy preparation
- Quality Control Quality Control
- GMP Grade Cytokine GMP Grade Cytokine
- Common Chemicals & Buffers & Lab Tools Common Chemicals & Buffers & Lab Tools
- Life Science Life Science
- Exosome Research Exosome Research
- Spectradyne-Microfluidic Nanoparticle Analysis
- Corning-VideoDrop
- Immunostep- Lyophilized Exosome Standards
- Immunostep-ExoStep Platform
- Immunostep-Exosome Isolation Columns (SEC)
- GeneCopoeia Lentifect™ Exosome Labeling Lentiviral
- GeneCopoeia miProfile™ Exosome miRNA qPCR arrays
- Exosome Memebrane / Protein Dye
- DNA/RNA Research
- miRNA/shRNA/siRNA Research
- Protein Research
- In Vivo Assay In Vivo Assay
- Cloning & Clone Collection
- Transfection & Transduction
- IHC
- Cell-Based Assay
- Mitochondria Research Mitochondria Research
- Antibody/Antigen
- ELISA ELISA
- Antibody Labeling Antibody Labeling
- mRNA/Oligos/Nucleotide
- Microbial Research Microbial Research
- Ultra high content imaging
- Tumor Research Tumor Research
- Microarray Microarray
- Exosome Research
- Pharma Manufacturing & QC Pharma Manufacturing & QC
- Impurity Detection
- Micoplasma Detection Micoplasma Detection
- Endotoxin Remove Endotoxin Remove
- Visual Inspection Visual Inspection
- Mycobacteria Detection Mycobacteria Detection
- Nanoparticle Analyzer Nanoparticle Analyzer
- Cell Culture
- 最新消息
- 促銷活動
- 代理品牌
- AAjinomoto-iPSAbcamAbebioAbbexaAbcoreAlpha-TecAkadeum
- BBiCell ScientificBIO-HELIXBiolineBioLife SolutionsBio X Cell
- CCorningCYGNUSCompass BiomedicalCUSABIOCytori Therapeutics IncCANDOR BioscienceCreative BioMart
- DDojindo
- EExpression SystemsEastCoast BioElixirgen Scientific
- FFast Forward DiscoveriesFortius BioFisher Scientific
- GGoldBioGenlantisGeneCopoeia
- HHyTest Ltd
- IImmunostepiRealIrvine ScientificInVitriaImmuno-Biological Laboratories
- KKohjin BioKingfisher Biotech
- LLIPOSOMA ─ Clodronate Liposomes
- MMatrixome & NippiMedicagoMeridian Life Science
- NNonacus
- QQIAGEN
- PProtein ArkProFoldin-ProteomicsProSpec
- SSHIMADZUSignaGenScyTek Laboratories IncSMOBIOSpectradyne
- TTriLink BiotechnologiesTymora Analytical
- WWorthingtonWaken X BioLife Solutions
- 關於我們
- 聯絡我們
News
HomeNews
2024/01/31
TriLink|研究聚焦:新型 mRNA 傳遞系統 ── 提供器官的特異性標靶

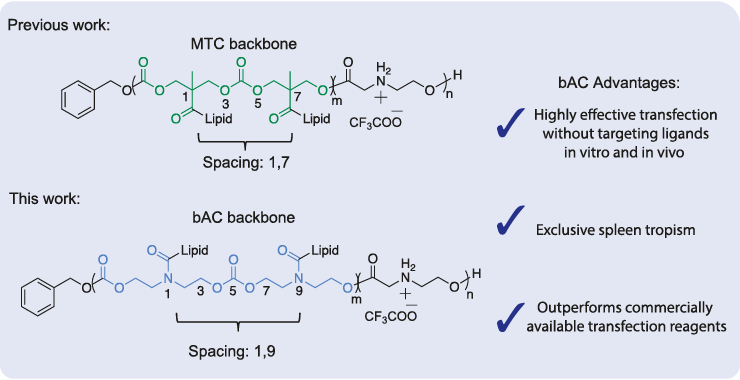
Messenger RNA (mRNA) 療法需要更有效率與選擇性的傳遞系統,才能使得充份發揮其潛力。為了達成這個目的,史丹佛大學的研究人員開發了一種新型的電荷改變可釋放轉運蛋白 (charge-altering releasable transporters, CART),其與先前的CART 不同之處在於其 beta amido carbonate backbone(bAC) 和側鏈間距。這些修飾增強了 mRNA 在 primary T 淋巴細胞的體外轉染,並在體內呈現出高度選擇性的器官特異性,顯示了 bAC CART 在治療應用中具有廣泛的用途。TriLink 的 CleanCap® mRNA 產品促進了此項研究的發展,該研究近期發表於 Nature Communications 上。

CART 是脂質納米顆粒的獨特替代品
雖然脂質納米顆粒 (LNP) 在傳遞 mRNA 療法方面取得了相當大的成功,但其應用現今僅限於肌肉注射的給藥和肝細胞的血管內標靶。CART 於 2016年首次做為傳遞 mRNA 的替代工具被報導,可望用於改善細胞和器官的特異性。為了發揮其作用,CART 最初最為複合、保護和傳遞其 mRNA 貨物的陽離子,接著藉由其獨特的電荷中和分子內重排 (從帶電胺到中性醯胺) 以觸發在細胞內的釋放。
CART 修飾可改善 T 淋巴細胞轉染
T 淋巴細胞是相當重要的治療標靶標的,但將遺傳物質對其進行轉染是一個重大挑戰。為了解決這個問題,史丹佛大學的研究人員先前將CART脂質組成修改為 oleyl-nonenyl amino CARTs (ONA CARTs),增強了 T 淋巴細胞株 Jurkat 細胞的 mRNA 轉染效率。然而,ONA CARTs 在轉染 primary T 細胞的效果較差,需進行進一步調整。在此篇最新的研究中,敘述了將 CART methyl-trimethylene carbonate (MTC) backbone替換為具有可變側鏈間距的 bAC backbone 所造成的影響且皆經過體外和體內測試。
bAC CART 可增強 Jurkat 細胞的 mRNA 轉染功效
此篇研究使用 24 種不同脂質組成的bAC CART library將eGFP mRNA (TriLink) 轉染 Jurkat 細胞。流式細胞儀的結果顯示,表現最佳的 bAC CART (bAC-7c) 的轉染效率為 78%,而 ONA CART 對照組的轉染效率僅為 46%,進而也表示蛋白質表現增加。
bAC CART 能夠離體生成高細胞毒性 CAR-T 細胞
為了驗證 bAC CART 的治療潛力,作者利用 bAC-7c 或 ONA-CART 將 mRNA encoding anti-human CD19 轉染到活化的 CD8 + T 細胞 (從健康人提供者中分離)。然後將所得到的anti-hCD19 CAR-T 細胞與 B 細胞前驅白血病細胞株共同培養,以研究anti-hCD19 CAR 對 CD8 + T 細胞功能的影響。mCherry mRNA (TriLink) 做為對照組。發現與 ONA CART 相比,使用 bAC-7c 轉染的細胞anti-hCD19 CAR 表達量顯著更高,這個結果表示了 藉由 CD19-CAR 的交互作用可特異性標靶至白血病細胞。
bAC CART 在體內能夠有效轉染 T 淋巴細胞
史丹佛大學研究人員在體外實驗中觀察到 primary T 淋巴細胞的有效轉染後,試圖在體內實驗中獲得類似的結果。他們將 bAC CART 與 luciferase mRNA (TriLink) 形成 complex,以靜脈注射進 BALB/c 小鼠,並透過全身成像和離體器官的流式細胞儀分析來量測 luciferase 的表達。其結果顯示,bAC-7c 的表現量優於其他已測試的 bAC CART,且 luciferase 表現比其 MTC 類似物高出了十倍,且在脾臟的吸收具有高度選擇性 (>90%)。隨後,對 Cre 重組酶小鼠模型靜脈注射 Cre mRNA (TriLink),發現脾臟中大多數 CD45 +白血球亞群(包括 CD4 +和 CD8 + T 細胞)參與了 mRNA internalization。最重要的是,bAC CART 在不需要標靶配體 (targeting ligands) 的情況下實現器官特異性的能力為 RNA 的傳遞開闢了新的機會。
原始文章>>
圖片來源>>

CART 是脂質納米顆粒的獨特替代品
雖然脂質納米顆粒 (LNP) 在傳遞 mRNA 療法方面取得了相當大的成功,但其應用現今僅限於肌肉注射的給藥和肝細胞的血管內標靶。CART 於 2016年首次做為傳遞 mRNA 的替代工具被報導,可望用於改善細胞和器官的特異性。為了發揮其作用,CART 最初最為複合、保護和傳遞其 mRNA 貨物的陽離子,接著藉由其獨特的電荷中和分子內重排 (從帶電胺到中性醯胺) 以觸發在細胞內的釋放。
CART 修飾可改善 T 淋巴細胞轉染
T 淋巴細胞是相當重要的治療標靶標的,但將遺傳物質對其進行轉染是一個重大挑戰。為了解決這個問題,史丹佛大學的研究人員先前將CART脂質組成修改為 oleyl-nonenyl amino CARTs (ONA CARTs),增強了 T 淋巴細胞株 Jurkat 細胞的 mRNA 轉染效率。然而,ONA CARTs 在轉染 primary T 細胞的效果較差,需進行進一步調整。在此篇最新的研究中,敘述了將 CART methyl-trimethylene carbonate (MTC) backbone替換為具有可變側鏈間距的 bAC backbone 所造成的影響且皆經過體外和體內測試。
bAC CART 可增強 Jurkat 細胞的 mRNA 轉染功效
此篇研究使用 24 種不同脂質組成的bAC CART library將eGFP mRNA (TriLink) 轉染 Jurkat 細胞。流式細胞儀的結果顯示,表現最佳的 bAC CART (bAC-7c) 的轉染效率為 78%,而 ONA CART 對照組的轉染效率僅為 46%,進而也表示蛋白質表現增加。
bAC CART 能夠離體生成高細胞毒性 CAR-T 細胞
為了驗證 bAC CART 的治療潛力,作者利用 bAC-7c 或 ONA-CART 將 mRNA encoding anti-human CD19 轉染到活化的 CD8 + T 細胞 (從健康人提供者中分離)。然後將所得到的anti-hCD19 CAR-T 細胞與 B 細胞前驅白血病細胞株共同培養,以研究anti-hCD19 CAR 對 CD8 + T 細胞功能的影響。mCherry mRNA (TriLink) 做為對照組。發現與 ONA CART 相比,使用 bAC-7c 轉染的細胞anti-hCD19 CAR 表達量顯著更高,這個結果表示了 藉由 CD19-CAR 的交互作用可特異性標靶至白血病細胞。
bAC CART 在體內能夠有效轉染 T 淋巴細胞
史丹佛大學研究人員在體外實驗中觀察到 primary T 淋巴細胞的有效轉染後,試圖在體內實驗中獲得類似的結果。他們將 bAC CART 與 luciferase mRNA (TriLink) 形成 complex,以靜脈注射進 BALB/c 小鼠,並透過全身成像和離體器官的流式細胞儀分析來量測 luciferase 的表達。其結果顯示,bAC-7c 的表現量優於其他已測試的 bAC CART,且 luciferase 表現比其 MTC 類似物高出了十倍,且在脾臟的吸收具有高度選擇性 (>90%)。隨後,對 Cre 重組酶小鼠模型靜脈注射 Cre mRNA (TriLink),發現脾臟中大多數 CD45 +白血球亞群(包括 CD4 +和 CD8 + T 細胞)參與了 mRNA internalization。最重要的是,bAC CART 在不需要標靶配體 (targeting ligands) 的情況下實現器官特異性的能力為 RNA 的傳遞開闢了新的機會。
原始文章>>

圖片來源>>
TriLink 特色產品
- CleanCap® EGFP mRNA
- CleanCap® mCherry mRNA (5moU)
- CleanCap® FLuc mRNA (5moU)
- CleanCap® Cre mRNA (5moU)
參考文獻:Li, Z., Amaya, L., Pi, R. et al. Charge-altering releasable transporters enhance mRNA delivery in vitro and exhibit in vivo tropism. Nat Commun 14, 6983 (2023)
